Jonathan Latham Independent Science News. Lunes, 25 Abril, 2016
http://www.independentsciencenews.org/science-media/gods-red-pencil-crispr-and-t...
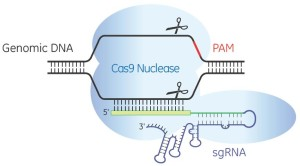
Por el bien de todos los lugares del mundo en los que la aceptación pública de la ingeniería genética aún no es completa, la maquinaria de relaciones públicas está funcionando ahora mismo a plena potencia. El tema son los nuevos métodos existentes para alterar el ADN de los organismos vivos. «La Edición Fácil del ADN Va a Rehacer el Mundo. Abrocháos los Cinturones», «Tenemos la Tecnología para Destruir a Todos los Mosquitos del Zika», o «CRISPR: la edición génica es sólo el principio». (CRISPR es una forma de abreviar CRISPR/cas9, que es a su vez una forma de abreviar «Repeticiones Palindrómicas Cortas Agrupadas y Regularmente Interespaciadas/Proteína asociada a CRISPR 9»; Jinek et al., 2012. Es una combinación de un ARN guía y una proteína que puede cortar el ADN.)
La arrogancia resulta alarmante; pero el elemento más sutil de esta campaña de propaganda es la mayor y más peligrosa improbabilidad de todas: que CRISPR y otras técnicas relacionadas sean «edición génica» (Fichtner et al., 2014); es decir, que sean capaces de generar alteraciones precisas y específicas en el ADN.
Hasta los medios «serios» lo dicen. La revista Nature publicaba en julio de 2015 un artículo titulado «Cerdos super-musculosos creados mediante un pequeño retoque genético» Dos juicios de valor en un titular de siete palabras: «pequeño» y «retoque», ninguno de los cuales estaba respaldado por el contenido del artículo. En la misma línea, la semana pasada en la sección de opinión del NY Times aparecía «Retocando los genes para salvar las especies».
¿Por qué sé que esto es una guerra propagandística? Se lo he oído decir a ellos mismos. En febrero estuve en una reunión de la ONU sobre biotecnología, en Roma (Italia), donde un representante veterano de la Biotechnology Industry Organisation (BIO) explicaba a los delegados allí reunidos la «exquisita especificidad» y «precisión» de la edición genómica.
Mito 1: Las tecnologías de edición genómica actuales no son propensas a errores
La postura de BIO no coincide con los datos existentes. Si CRISPR ya fuera precisa y específica no habría, por ejemplo, publicaciones en revistas científicas de primer nivel con el título «Mejorando la especificidad de las nucleasas CRISPR-Cas mediante la utilización de ARNs guía truncados». Y estas no empezarían describiendo cómo las versiones habituales de CRISPR «pueden inducir mutaciones en lugares que difieren hasta en cinco nucleótidos del sitio diana previsto», es decir que CRISPR puede actuar en sitios desconocidos del genoma en donde no se quiere que actúe (Fu et al., 2014).
Así que es la propia CRISPR la que necesita algunos retoques antes de poder utilizarse para obtener productos comerciales seguros, lo cual expone el primer error del argumento en favor de su precisión. Hasta ahora no es técnicamente posible hacer un (y sólo uno) cambio aislado en el genoma usando CRISPR y estar seguro de que ha sido así (Fichtner et al., 2014). Como señala Fichtner «en mamíferos, Cas9 da lugar a un gran número de efectos no-diana». Y al menos hasta que aparezcan versiones modificadas, esto limitará la seguridad, y esperemos que la aplicación, de biotecnologías relacionadas con CRISPR. No hay, además, ninguna garantía de que sea biológicamente posible obtener versiones más precisas de CRISPR. Técnicamente, por tanto, la precisión es un mito: ningún tipo de edición génica puede hacer lo que se está afirmando que pueden hacer.
Mito 2: Precisión equivale a control
El segundo error clave de los promotores de CRISPR es dar por hecho que, incluso aunque tuviéramos una precisión completa, esto permitiría controlar las consecuencias en el organismo resultante.
Supongamos que yo, que no hablo chino, quisiera eliminar de forma precisa un caracter de un texto escrito en chino, o una línea, o una página. Tendría un cien por cien de precisión, pero ningún control sobre los cambios en el significado. La precisión, por tanto, sólo es útil en la medida en que va acompañada de comprensión, y ningún biólogo puede afirmar que en este momento entendamos el ADN – ¿si no por qué lo seguimos estudiando?
Un ejemplo clásico de cómo una secuencia de ADN puede seguir revelando funciones inesperadas décadas después de su descubrimiento es el promotor 35S del CaMV, una secuencia de ADN utilizada durante casi veinte años en las plantas transgénicas comercializadas. El ADN CaMV 35S se describe en todas las aplicaciones de uso comercial como un simple «promotor» de ADN (un «interruptor» de la expresión génica).
En 1999, sin embargo, se descubrió que el «promotor» CaMV 35S era además un «hotspot», un sitio donde la recombinación es más frecuente (Kohli et al., 1999). En 2011 se descubrió que producía grandes cantidades de pequeños ARNs, que probablemente funcionan como señuelos para neutralizar el sistema inmune de la planta (Blevins et al., 2011). Incluso un año más tarde las autoridades descubrieron que contenía un gen viral superpuesto, cuyas funciones aún se están determinando (Podevin y du Jardin, 2012). ¿Llegaremos en algún momento a saber lo suficiente sobre cualquier secuencia de ADN para describir los cambios que realicemos sobre ella como «ediciones»?
Mito 3: Las funciones del ADN son modulares y los cambios son predecibles
El tercer error de los defensores de CRISPR es dar a entender que se puede suponer que los cambios en la función génica son discretos y están contenidos.
El concepto de edición precisa del genoma que conduce a un resultado biológico definido depende fuertemente de nuestra concepción de que los genes dan lugar a productos simples. Este es el paradigma genético que aprendemos en el colegio, y también el que se presenta al público y que supone la base del pensamiento de los investigadores en genética molecular.
Sin embargo, es probable que no exista una ruta definida, discreta o simple de un gen a un rasgo. La mayoría de funciones génicas están reguladas mediante redes bioquímicas altamente complejas que dependen de un gran número de factores que las condicionan, como la presencia de otros genes y sus variantes, las condiciones del medio, la edad del organismo, el azar, etc. Los genetistas y biólogos moleculares, sin embargo, desde la época de Gregor Mendel, se han esforzado por encontrar o crear sistemas experimentales artificiales en los que las fuentes de variación ambientales o de otro tipo se ven minimizadas, para así no distraer del descubrimiento genético «realmente importante».
Pero al descartar aquellos organismos o rasgos que no cumplen con sus expectativas, los genetistas y biólogos moleculares se han construido un argumento circular en favor de relatos deterministas más «ingenuos» de la función génica. Su paradigma suele restar importancia a la enorme complejidad con la que se transmite la información (en ambas direcciones) entre los organismos y sus genomas. Ha creado un sesgo inmenso y prácticamente no estudiado en la comprensión del público por defecto de los genes y el ADN.
Esto no lo digo yo. Lo dice Richard Lewontin de la Universidad de Harvard, probablemente el genetista más famoso de nuestro tiempo.
Los beneficios del determinismo genético para los arquitectos de la industria biotecnológica son enormes. Dado que básicamente supone ver a los organismos como robots manejados por mini-dictadores (en lugar de, por ejemplo, como sistemas con propiedades emergentes) y a las funciones de los genes como algo específico y claramente definido en lugar de difuso e impredecible, simplifica enormemente sus argumentos de venta y plantea la evaluación de riesgos como algo innecesario.
El problema se hace más visible, sin embargo, cuando esta conceptualización simplista de la genética se aplica al mundo real, en situaciones que no han sido preparadas de antemano. En el caso de los cerdos «super-musculosos» que aparecieron en Nature, no sólo son más fuertes. También tienen más piel que los cubre y unos huesos más fuertes para poder soportar su estructura. También, aparentemente, tienen dificultades para dar a luz; y si en algún momento se les soltase en la naturaleza, seguramente tendrían que comer más. De esta forma, un retoque genético supuestamente simple puede tener efectos sobre un organismo a un nivel mucho más amplio durante su ciclo de vida.
Nature también reveló que treinta de los treinta y dos cerdos murieron prematuramente, y en el momento en el que se entrevistó a los autores del estudio se consideraba que sólo uno de los animales estaba sano. Vaya con la precisión.
La historia interminable
¿Por qué es importante esta discusión sobre la precisión? Porque en los últimos setenta años todas las tecnologías químicas y biológicas, desde la ingeniería genética hasta los pesticidas, se han construido sobre el mito de la precisión y la especificidad. Se han adoptado sobre la base de que funcionarían sin ningún efecto secundario o sin complicaciones inesperadas. Sin embargo las consecuencias catastróficas del DDT, la pintura con plomo, el agente naranja, la atrazina, el C8, el amianto, el clordano, los PCBs, etcétera, cuando se tiene en cuenta toda la información, han sido ejemplos que han ido desmontando este mito fundacional de la precisión y la especificidad.
En cualquier caso, con ayuda de los propagandistas de la industria, sus amigos de los medios de comunicación e incluso las Naciones Unidas se nos está vendiendo otra vez el evangelio de la precisión. Pero lo mires por donde lo mires, la precisión es un cuento y debería ser tratado como tal.
Todo lo relacionado con CRISPR y otras nuevas biotecnologías relacionadas de «edición génica» está siendo sujeto de una intensa actividad entre bambalinas. El Departamento de Agricultura estadounidense acaba de explicar que no regulará aquellos organismos cuyos genomas hayan sido editados, dado que ni siquiera los considera OMG. La UE estaba a punto de decir que sí eran OMG, pero EEUU ha hecho que se lo replanteen; el propio EEUU está en proceso de reformular por completo su regulación respecto a OMG. ¿Se basarán las futuras regulaciones de seguridad de los OMG en una versión de colegio de la genética y una interpretación de la edición génica diseñada en el departamento de relaciones públicas de una multinacional? Si nos basamos en cómo ha ido la historia, así será.
Referencias
Blevins, Todd, Rajendran Rajeswaran, Michael Aregger, Basanta K. Borah, Mikhail Schepetilnikov, Loïc Baerlocher, Laurent Farinelli, Frederick Meins Jr, Thomas Hohn and Mikhail M. Pooggin (2011) Massive production of small RNAs from a non-coding region of Cauliflower mosaic virus in plant defense and viral counter-defense. Nucleic Acids Research 39: 5003-5014.
Franziska Fichtner, Reynel Urrea Castellanos, and Bekir Ülker (2014) Precision genetic modifications: a new era in molecular biology and crop improvement. Planta 239: 921-939 (doi:10.1007/s00425-014-2029-y.
Fu Y, Foden JA, Khayter C, Maeder ML, Reyon D, Joung JK, Sander JD (2013) High-frequency off-target mutagenesis induced by CRISPR-Cas nucleases in human cells. Nat Biotechnol 31:822–826.
Fu Y, Jeffry D. Sander, Deepak Reyon, Vincent M. Cascio, and J. Keith Joung (2014) Improving CRISPR-Cas nuclease specificity using truncated guide RNAs. Nat Biotechnol. 32: 279–284.
Martin Jinek, Krzysztof Chylinski, Ines Fonfara, Michael Hauer, Jennifer A. Doudna, Emmanuelle Charpentier (2012) A Programmable Dual-RNA – Guided DNA Endonuclease in Adaptive Bacterial Immunity Science 337: 816-821.
Podevin N and du Jardin P (2012) Possible consequences of the overlap between the CaMV 35S promoter regions in plant transformation vectors used and the viral gene VI in transgenic plants. GM Crops and Food 3: 1-5.
==C